Usage de l’acide citrique pour le décapage et la passivation de l’acier inoxydable austénitique 316L
Par S. Frappart(a), V. Amice(a), J-M. Corrieu(a), M. Goron(b), J. Benabes(b), D. Colin(a)
(a) Naval Group, Technocampus Océan, 5 rue de l’Halbrane, 44 340 Bouguenais (b) Sirehna, Technocampus Océan, 5 rue de l’Halbrane, 44 340 Bouguenais
Actuellement, la solution de référence pour atteindre les critères de mise en propreté et de tenue à la corrosion des aciers inoxydables austénitiques reste l’usage d’acide fluonitrique (HF et HNO3). Ces produits sont néanmoins dangereux et ne peuvent pas toujours être appliqués, en particulier sur des surfaces de grandes dimensions ou dans des circuits déjà en exploitation. Il semble donc opportun d’investiguer des procédés alternatifs moins nocifs de décapage et de passivation des aciers inoxydables austénitiques pour la mise en propreté.
La mise en œuvre de l’acide citrique C6H8O7 pour remplacer les acides suscités apparaît une piste intéressante à évaluer. Il est autorisé pour la passivation dans certains référentiels normatifs puisqu’il est proposé par les normes de référence ASTM A380 ou ASTM A967 pour la passivation des aciers inoxydables. Des résultats de la littérature ont démontré qu’une concentration de 4 % massique, une température variant de 60 à 80 °C et une durée de 120 minutes permettraient d’obtenir la meilleure passivation. Plusieurs études ont d’ailleurs vérifié que la passivation citrique pouvait offrir une efficacité équivalente à l’acide nitrique [R1]. Mais ni la littérature ni la normalisation ne discutent de l’usage de l’acide citrique sur la décontamination ferritique.
Une étude expérimentale a donc été menée afin de définir l’influence et les plages des paramètres essentiels (principalement la concentration, la température et la durée du traitement) sur la décontamination ferritique et la passivation du 316L à la suite d’un n système de nettoyage réalisé en immersion.
1. Protocole expérimental
1.1. Subjectile
Le matériau de référence choisi pour cette étude est un acier austénitique inoxydable 316L (X2CrNiMo17-12-3). Les éprouvettes ont été grenaillées recto/verso avec un abrasif en acier carbone pour atteindre un degré de soin Sa3 selon le standard NF EN ISO 8501-1 et une rugosité Moyen (G) selon NF EN ISO 8503-1 (le profil de rugosité Ry est compris entre 60 et 100 µm).
Des essais au ferricyanure de potassium et à la pulvérisation d’eau déminéralisée, prévus par le RCC-M, révèlent clairement la présence d’incrustations ferreuses (figure 1). Dans le cadre d’une étude de R&D, ce mode opératoire permet d’obtenir un état de pollution très enveloppe et est plus répétable dans le cadre d’une étude d’influence de paramètres d’un procédé.
1.2. Systèmes de nettoyage
Plusieurs niveaux ont été appliqués aux paramètres essentiels :
• concentration C en acide citrique : 2, 4, 7 et 10 % massique ;
• température θ : 20, 40, 60 et 80 °C ;
• temps d’immersion t : 30 / 60 / 90 / 120 / 180 minutes.
(Cf. figure 1)
Les solutions de nettoyage sont préparées à partir d’acide citrique sous forme de poudre de la marque VWR, de référence 20282.362 et de pureté 99,9 %. Les systèmes de nettoyage ont été réalisés selon la séquence de la figure 2.a. Le dégraissage est assuré par une solution à 3 % massique de Radiapol et tous les rinçages (intermédiaires et finaux) sont réalisés à l’eau déminéralisée de laboratoire (18,2 MΩ.cm). Pour l’étape de décontamination et passivation à l’acide citrique, les échantillons sont immergés dans un bécher en respectant le ratio surface de métal exposée / volume de la solution (figure 2.b, bécher d’1 L recouvert d’une plaque de verre pour maintenir la concentration du fait de l’évaporation), dont la température est maintenue constante à ± 1°C par un bac chauffant. Le séchage est effectué à l’air calme.
(Cf. figure 2)
1.3. Définition du plan d’expérience
Un plan d’expérience a été réalisé afin d’optimiser les études expérimentales de laboratoire. La méthode permet l’évaluation de l’influence des variabales essentielles et de leurs intéractions.
Les données expérimentales de sortie sont fondées sur la propreté de la surface avec un résultat binaire de type 0=non conforme / 1=conforme selon le critère du test considéré. L’objectif est d’obtenir le domaine des jeux de paramètres pour atteindre le niveau de propreté requis et d’en déduire un jeu optimal. Les deux tests réalisés sont :
• La « Propreté Surfacique », qui est un critère de propreté purement visuel traduisant l’absence visuelle d’oxydation (« rouille » orange) à la surface après système de nettoyage ;
• La « Propreté Test Ferricyanure » est un test physico-chimique au ferricyanure de potassium, mettant en évidence la présence de pollution ferritique à la surface (goutte initialement jaune qui devient bleue au contact de particules de fer au degré d’oxydation 0).
Ces deux niveaux de propreté ont été investigués de manière à définir, si possible, les plages de variables essentielles spécifiques à chaque type de pollution de surface (fleur de rouille plutôt pulvérulente et faiblement adhérente, incrustation mécanique de particules ferritiques).
Le tableau 1 présente l’ensemble des systèmes de nettoyage réalisés. Le plan d’expérience initial (bains 0 à 20) est celui permettant d’aboutir à deux modèles mathématiques préliminaires. Des essais de validation ont été préconisés pour confirmer ces modèles (bains 21 à 23). Compte tenu des résultats, des essais complémentaires ont été ajoutés à la matrice (bains 24 à 30). Des modèles prédictifs ont donc été proposés sur les 30 essais du Tableau 1.
1.4. Méthodes de caractérisation
1.4.1. Caractérisation de la dépollution ferritique
Cet essai permet d’évaluer l’efficacité du système de nettoyage sur la désoxydation des particules ferreuses de surface. Il est réalisé en utilisant du ferricyanure de potassium qui est très sensible à la présence d’incrustation ferreuse sur des pièces en acier inoxydable austénitique (modification de coloration : jaune -> bleu-noir). Le ferricyanure ne peut pas être appliqué sur l’ensemble de la surface d’où le choix arbitraire de 9 gouttes pour caractériser celle-ci ; la pollution étant homogène et la décontamination aussi, le sondage par 9 tâches donne une information suffisante du résultat. Le critère retenu indique que la surface examinée ne doit présenter aucune indication de contamination ou incrustation ferritique (chaque goutte de ferricyanure de potassium doit garder sa coloration jaune initiale).
1.4.2. Caractérisation de la propreté surfacique
La solution de dégraissage à la lessive alcaline provoque une oxydation des particules ferritiques incrustées, menant à la formation d’un voile d’oxyde de fer avant l’étape de décapage/passivation. C’est ce que l’on appelle le flash-rust. Le faciès représentatif est proche de celui de la figure 1.b.
Une fois le système de nettoyage complet terminé, il faut réaliser un examen visuel des surfaces (à l’œil nu sans grossissement) avec un éclairage en lumière du jour pour vérifier que le jeu de variables essentielles permet de nettoyer ce type de pollution. Le critère retenu indique que la surface examinée ne doit présenter aucun produit de corrosion ou de corps étranger.
1.4.3. Caractérisation de la passivation
À la suite du nettoyage des surfaces, une évaluation de la passivation est réalisée par électrochimie, en traçant la courbe de polarisation anodique et en déterminant les grandeurs caractéristiques relatives à la réactivité du matériau dans le milieu d’étude (potentiel de corrosion Ecorr, intensité de la corrosion, largeur du domaine de passivation). Cette caractérisation est réalisée sur les systèmes pour lesquels la conformité a été prononcée au test Ferricyanure, jugé plus sévère et plus discriminant.
Le milieu considéré est une solution aérée à 3,5 % massique en NaCl et à la température ambiante du laboratoire (20 ± 3 °C). Les essais sont réalisés sans agitation dans une cellule électrochimique GAMRY Paint Cell dont la surface active est de 15,9 cm² (diamètre = 4,5 cm). Le potentiel est mesuré via une électrode de référence au calomel saturé (ECS) et le courant par l’intermédiaire d’une grille de platine. Le potentiel d’abandon Ecorr est suivi pendant 1 heure et la courbe de polarisation anodique est tracée de – 0,05 V/Ecorr jusqu’à un seuil en courant de 5.10-3 A/cm² à une vitesse de balayage de 0,16 mV/s. Le potentiostat/galvanostat utilisé est un AMETEK VersaSTAT 3.
2. Résultats – propreté de surface
2.1. Résultats bruts sommaires
Les résultats expérimentaux, issus du plan d’expériences, sont donnés dans le tableau 1, mais ne peuvent raisonnablement pas être illustrés dans leur globalité dans le présent document. La figure 3 montre des exemples de configurations conformes et non conformes. Les observations visuelles des 30 éprouvettes permettent d’affirmer que la propreté peut être obtenue quand certains jeux de variables essentielles sont respectés (figures c et d). C’est ce que nous allons décrire dans les paragraphes suivants.
2.2. Iconographie des interactions et modèles de régression
La première étape de l’analyse passe par la représentation de l’iconographie des interactions (figure 4) : un trait plein correspond à une corrélation positive remarquable et un trait pointillé correspond à une corrélation négative remarquable (les positions ou la longueur des traits ont peu d’importance). Un lien entre deux variables est dit « remarquable » (il est tracé) si la corrélation subsiste quand n’importe laquelle des autres variables est constante. Les iconographies de la figure 4 montrent, sur les deux types de propreté, un effet positif de la température (augmenter la température augmente la propreté), un effet positif du temps (augmenter le temps augmente la propreté) et un effet négatif de la concentration (la concentration a peu d’effet dans la gamme testée). La figure 4 illustre également les interactions entre les variables sur la propreté de surface. Nous retrouvons les liens positifs avec la température et le temps, ainsi que le lien négatif avec la concentration. Les travaux de Yasensky et al.[2] et de Gaydos[3] ont également mis en évidence que la concentration en acide citrique influe peu sur la résistance à la corrosion d’acier inoxydable austénitique à la suite d’une passivation obtenue soit par l’acide nitrique soit par l’acide citrique, au contraire de la température et du temps d’immersion.
Les modèles de régression multiple ont permis de définir des équations contenant des « interactions logiques » afin de coller au plus près aux phénomènes non linéaires (équations 1 et 2). Dans l’équation, les différents termes sont rangés par importance décroissante, chacun d’eux expliquant le résidu non expliqué par les précédents. La qualité des modèles est évaluée par les coefficients R2a (R2 ajusté), Q2 (R2 prédictif) et SEP (Erreur Standard) que nous ne détaillerons pas ici. Nous retiendrons juste que plus R2a et Q2 sont proches de 1, meilleurs sont l’ajustement et la prédiction du modèle. L’erreur standard (SEP) évalue l’erreur de prédiction du modèle, dans la même unité que la variable à prédire. Les deux modèles montrent que la concentration influe peu sur le résultat de la Propreté Test Ferricyanure, car elle n’intervient que dans le troisième terme du modèle ; elle semble avoir un peu plus d’influence sur la propreté surfacique (l’écart avec les autres termes est plus faible).
Équation 1
Propreté Test Ferricyanure = 0,5667 + 2,013 Température+Temps – 1,478 Temps]Temps + 1,385 Temps}Température + 0,6163 Température !Température – 0,3685 Concentration Temps
R2a = 0.792, Q2 = 0.752, SEP= 0.2758
Équation 2
Propreté Surfacique = 0,7333 + 1,968 Température]-Température + 0,6588 Concentration Temps + 0,5081 Concentration Temps + 0,3195
Température !Temps
R2a = 0.785, Q2 = 0.707, SEP= 0.2621
La figure 5 présente les résultats du modèle avec interactions logiques (équations 1 et 2) et donne, en vert, les conditions de propreté supérieures à 0,5 à chaque température. Selon les modèles, toutes les prédictions supérieures à 0,5 correspondent à une propreté réelle conforme, et toutes les prédictions inférieures à 0,5 correspondent à une propreté non conforme d’où le choix de 0,5 comme critère de conformité. De manière générale, les prédictions sont en accord avec les résultats expérimentaux. Comme vérifié par l’expérience, aucune configuration à 20 °C ne permet de nettoyer. Il semble absolument nécessaire de réaliser le traitement à une température supérieure ou égale à 40 °C, associé à une durée minimale de traitement. Cette représentation montre que la concentration influe peu sur le résultat de la propreté et qu’une variation de la concentration dans la gamme 2-10 % massique n’est pas dommageable sur le résultat de la propreté. Selon la figure 5.b, la propreté surfacique est plus facile à obtenir si la pollution est de type flash-rust. Malgré tout, les configurations à 20 °C ne permettent pas d’éliminer les oxydes de fer présents avant le traitement à l’acide citrique.
Selon le type de pollution, et en considérant l’erreur standard de prédiction des modèles (SEP), il est alors possible de définir un couple température/temps pour atteindre les exigences de propreté souhaitées (tableau 2).
3. Résultats – passivation
La figure 6 présente les courbes de polarisation pour les températures de traitement à 40 et 80 °C. Elles sont comparées à celles obtenues sur un état initial grenaillé (en noir) et un état décapé/passivé avec le système de nettoyage de référence à base d’acides fluorhydrique et nitrique (nommé HF+HNO3 en rouge). Les essais électrochimiques mettent en évidence que l’acide citrique permet de nettoyer et de passiver le 316L en abaissant significativement le courant par rapport à l’état initial pollué. Avec l’acide citrique, le comportement électrochimique est satisfaisant en milieu 3,5 % NaCl, indépendamment de la concentration de traitement. Un échantillon nettoyé à l’acide citrique apparaît toutefois moins performant qu’avec le traitement de passivation à l‘acide nitrique, même si un traitement à 80 °C permettrait de s’en rapprocher.
Ce constat doit être mis en regard de l’état grenaillé de la surface pouvant impliquer des potentiels de corrosion plus négatifs et des densités de courant plus élevées en raison de la rugosité[4, 5] et de la déformation plastique[6]. Par comparasion, le mélange HF+HNO3 décape la surface avec une perte de matière permettant ainsi d’annihiler la déformation plastique de surface liée au grenaillage, d’où un comportement électrochimique similaire pouvant être attendu, quel que soit l’état de surface considéré.
4. Conclusion
L’étude a permis de mettre en évidence que la concentration n’a pas ou peu d’influence sur la mise en propreté dans la gamme de concentration de 2-10 % massique. En revanche, la température et le temps de maintien sont de premier ordre. Il est nécessaire de travailler à une température supérieure ou égale à 40 °C, puisqu’une température de 20 °C n’a pas conduit à des résultats conformes.
Contrairement à l’action décapante de l’acide fluo-nitrique, l’acide citrique permet principalement de décontaminer (action sur les incrustations ferritiques) ou de désoxyder le flash-rust pulvérulent et faiblement adhérent. Pour un traitement en immersion et un couple température/temps respecté, il est donc possible de décontaminer la surface, tout en conférant une passivation acceptable. De meilleurs résultats sont pressentis pour des états de surface non grenaillés.
En perspective, une seconde phase d’étude du procédé viserait à démontrer la faisabilité d’un nettoyage à l’acide citrique par circulation en définissant, là-aussi, l’influence des variables essentielles (concentration, température, temps de contact et régime de circulation) sur la décontamination (Cf. figure 6).
Remerciements
Naval Group remercie Michel Lesty et Coryent Conseil pour la définition et l’analyse du plan d’expérience.
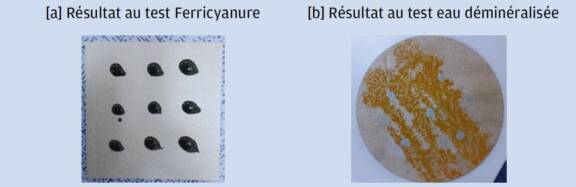
Figure 1. Test au ferricyanure de potassium [a] et à l’eau déminéralisée [b] sur une éprouvette décapée par projection d’abrasif à base de grenaille en acier carbone

Figure 2. Logigramme de la séquence du système de nettoyage et [b] Immersion en bécher d’1 litre et réalisée en condition statique, sans agitation, pour être représentatif des pratiques de l’atelier de décapage/passivation du centre de Nantes Indret.


Figure 3. Exemples de résultats du test au ferricyanure de potassium de la matrice d’essais du tableau 1 (code couleur : rouge – non conforme, vert – conforme)

Figure 4. Iconographie des corrélations. Traits pleins : corrélations positives, traits pointillés : corrélations négatives. Résulats sur les 30 essais

Figure 5. Résultat du modèle en fonction de la température, la concentration et la durée de traitement (en encadré noir : condition vérifiée par l’expérience, en encadré bleu pointillé : résultat contraire à l’expérience)

Tableau 2. Couple Température/Temps pour atteindre la propreté

Figure 6. Courbes de polarisation du 316L dans 3,5 % NaCl, à température ambiante


